
电话:029-87679000(总机)
地址:陕西省西安市西五路157号
邮编:710114
网址:www.2yuan.xjtu.edu.cn

电话:029-87679000(总机)
地址:陕西省西安市西五路157号
邮编:710114
网址:www.2yuan.xjtu.edu.cn

肝细胞癌(HCC)作为全球高发高致死癌症,2025年预计年确诊达100万人,因筛查不足、确诊仅有20-30%患者有手术切除机会,且局部治疗控制率低、靶向药延长生存期有限,亟需新型免疫激活策略。当前抗PD-1/PD-L1免疫疗法存在局限,ICIs单药治疗HCC缓解率低,传统抗PD-L1免疫治疗后,胞内PD-L1会重回细胞表面,并且仅靶向肿瘤细胞PD-L1无法消除巨噬细胞引起的免疫抑制。
2025年9月,西安交通大学第二附属医院肝病科纪泛扑教授团队、消化科王进海教授团队在《化学工程杂志》(Chemical Engineering Journal)(IF 13.2)在线发表题为《双重耗竭肿瘤细胞与巨噬细胞中PD-L1重激活肝细胞癌免疫攻击活性》(Dual-action PD-L1 depletion in tumor cells and macrophages revitalizes immune attack in hepatocellular carcinoma)的研究论文,研究开发出超分子PD-L1降解肽系统SupraPD1,可响应外界刺激自组装以实现肿瘤靶向富集,并能在高谷胱甘肽(GSH)的肿瘤微环境中释放药物;其独特的双靶向设计(靶向胞质PD-L1和胞内溶酶体),可通过竞争性抑制规避CMTM6介导的耐药通路,从根源上降低PD-L1水平,为传统ICIs疗法无效患者提供方案,也为HCC及其他实体瘤治疗开辟新路径。
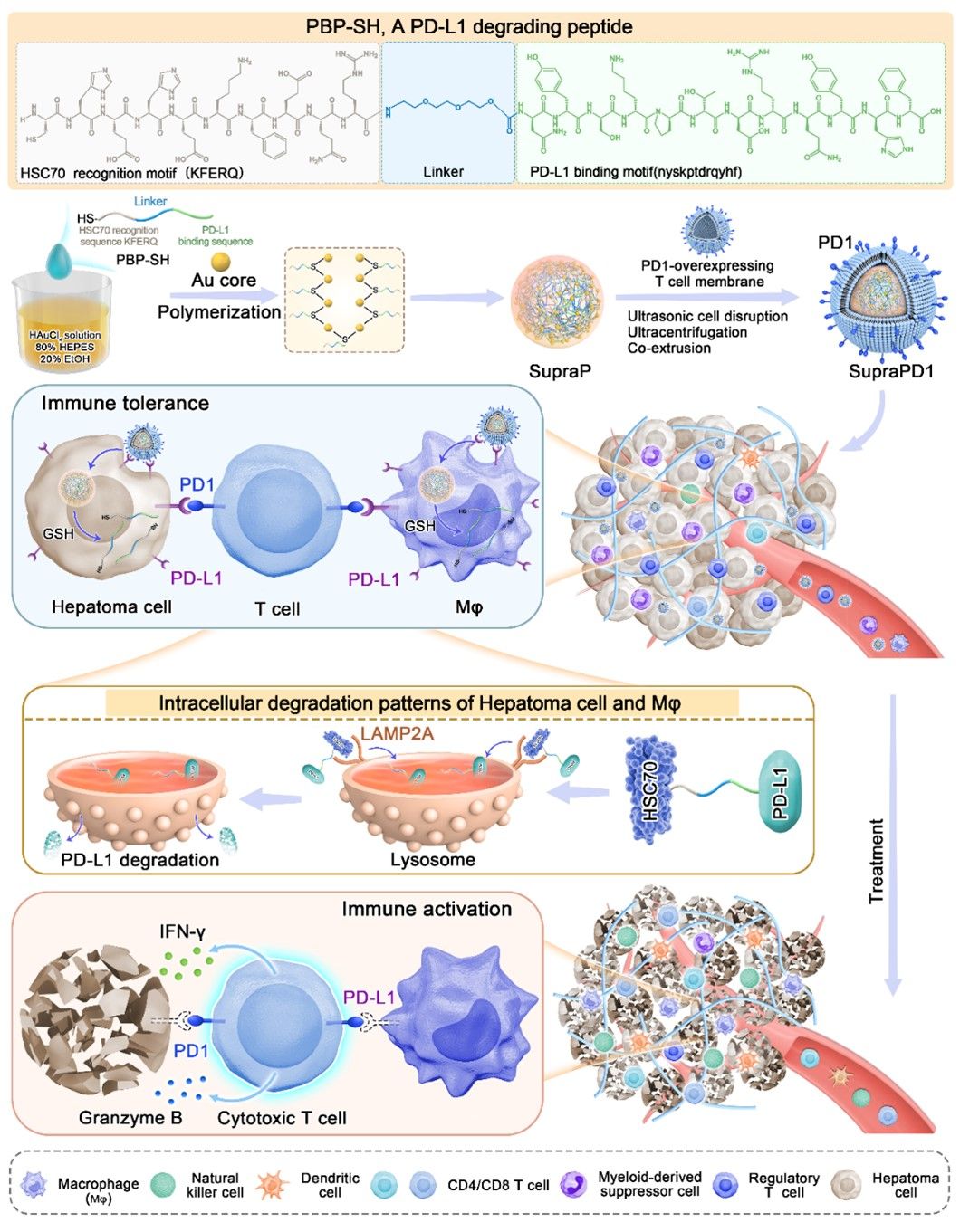
图1 SupraPD1的制备和治疗HCC的示意图(摘自Chemical Engineering Journal)
研究首先通过标准固相肽合成法制备含 HSC70/PD-L1 结合序列的 PBP 肽段,通过金亲和作用自组装成 SupraPD1纳米颗粒,再经高表达 PD-1 的 T 细胞膜修饰为 SupraPD1,提升 PD-L1 高表达细胞靶向性与摄取率。体外实验显示,SupraPD1 可剂量依赖性降解肝癌细胞与巨噬细胞中的 PD-L1,且用蛋白酶体抑制剂 MG132 无影响、溶酶体抑制剂(NH4Cl、氯喹)可抑制其降解作用,表明其通过溶酶体通路起效。激光共聚焦观察到,荧光标记的 SupraPD1 与 LAMP2、PD-L1 明显共定位,药物干预后 PD-L1 与 LAMP2 也共定位,证明药物两端核心功能区具特异性高亲和结合能力(图1)。
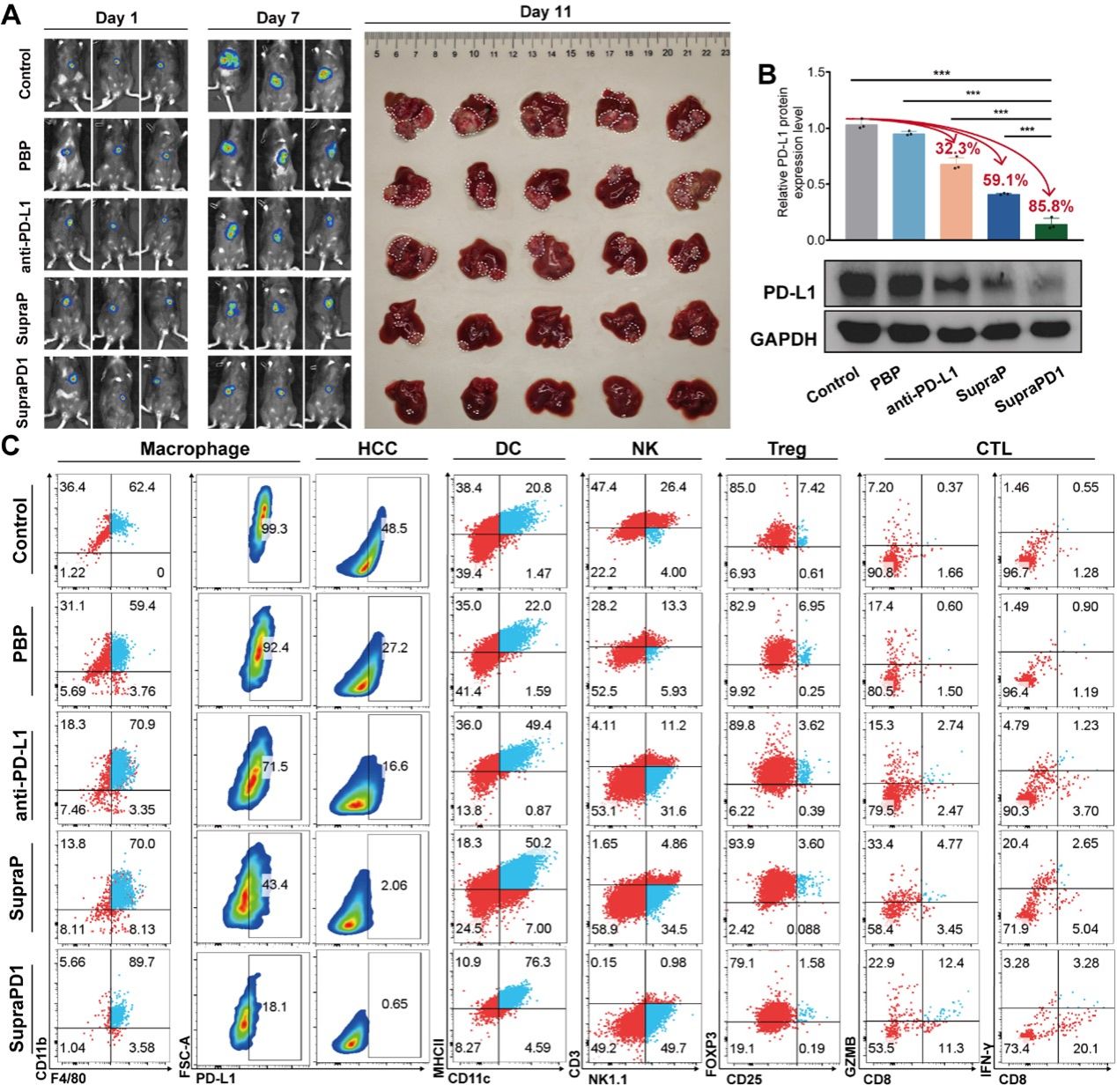
图2 SupraPD1在体内原位肝癌模型中增强抗肿瘤免疫疗法
进一步研究构建原位肝癌小鼠模型,验证 SupraPD1 效果。治疗后其组肿瘤负荷、结节大小数量均显著降低,且能减少肿瘤组织 PD-L1 表达,降低肝癌细胞增殖(Ki-67 水平),增加肿瘤细胞凋亡,单独膜成分无免疫调节作用。研究显示SupraPD1 可降低巨噬细胞与肝癌细胞 PD-L1 水平,提升 TME 中 DCs、NK 细胞及阳性 CTLs 浸润,减少 Tregs 浸润;显著延长荷瘤小鼠中位生存期。转录组学结果证明SupraPD1 组与对照/抗 PD-L1 组存在差异基因,GSEA 显示其下调细胞增殖,激活PD-1阻断及T细胞激活通路(图2)。上述研究结果在PD-L1单抗耐药HCC模型得到进一步验证。安全性评估显示SupraPD1的生物相容性良好,健康小鼠给药期间状态正常,体重稳定上升;血常规无异常,血清炎症因子无升高;肝肾功能生化指标正常,肝、肾、心、肺、脾组织无病理变化。
该项研究开发的SupraPD1可特异性识别PD-L1,在GSH响应下释放超分子肽PBP-SH(含 HSC70 和 PD-L1 结合基序),通过 HSC70 溶酶体通路降低肿瘤细胞与巨噬细胞的 PD-L1表达。在原位及ICIs耐药HCC模型中,其肿瘤抑制率超抗PD-L1抗体,还增加抗肿瘤免疫细胞浸润、减少 Tregs,延长荷瘤小鼠生存期,且生物安全性良好。该 PD-L1靶向平台可重塑免疫微环境、抑制 HCC进展,具有良好的临床转化潜能。
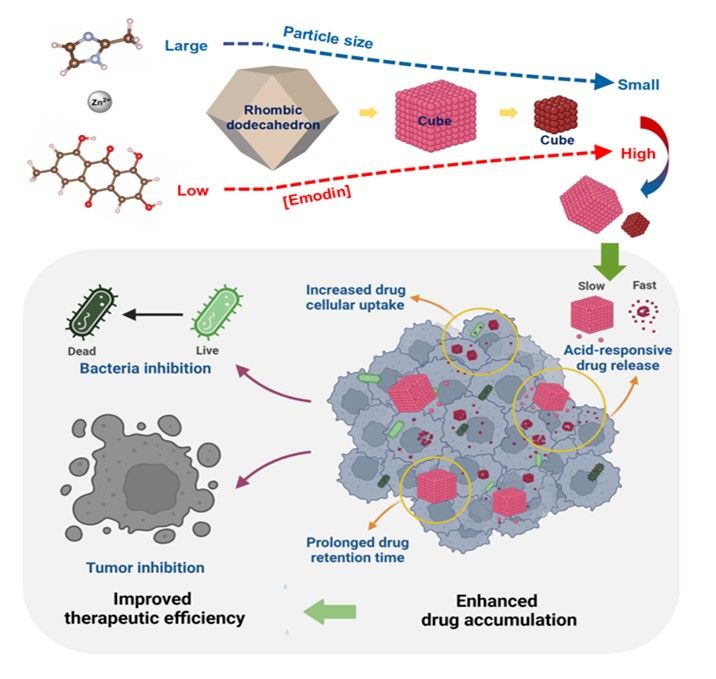
图3大黄素调控 ZIF-8 成核与晶体生长实现尺寸依赖型纳米治疗策略示意图(摘自Chemical Engineering Journal)
纳米技术的进步和对癌症生物学的深入理解,推动了纳米药物在癌症治疗中的应用。然而,纳米药物的尺寸因其体内转运、组织分布和代谢过程受生理尺寸阈值及尺寸依赖性的纳米-生物相互作用影响,进而影响治疗效果。我院肝病科纪泛扑教授团队研究发现,大黄的主要成分大黄素不仅能作为锌离子的结合模板,降低吉布斯自由能以加速成核过程,还可作为特定晶面的封端剂,调控晶体生长。这一双重机制可有效控制ZIF-8的结晶过程,从而精确调控负载大黄素的ZIF-8(E@Z)的尺寸与形貌(图3)。体外与体内实验表明,E@Z不仅增强大黄素的抗菌活性,还可通过尺寸依赖的降解特性实现药物在肿瘤部位的可控释放,显著提升抗肿瘤疗效。该研究为秦药大黄及其活性成分蒽醌类化合物在基于ZIF-8的尺寸依赖型纳米药物的开发和应用提供了理论与实践支持,也为乳腺癌和肝癌的靶向药物递送系统研究奠定了实验基础。相关研究成果以《Emodin regulates nucleation and crystal growth of ZIF-8 for developing the size-dependent nanotherapeutics》为题,发表于化学工程领域国际权威期刊《Chemical Engineering Journal》。
论文链接:https://www.sciencedirect.com/science/article/pii/S1385894725086772(研究一)
https://www.sciencedirect.com/science/article/pii/S1385894725081872(研究二)